Rangkuman
- Hukum Termodinamika I menyatakan bahwa “Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja.”
- Hukum Termodinamika II menyatakan bahwa “dari waktu ke waktu, perbedaan suhu, tekanan, dan potensi kimia dalam sistem fisik yang terisolasi akan menyeimbangkan diri”.
Termodinamika merupakan salah satu cabang ilmu fisika yang mempelajari tentang energi, khususnya mengenai hubungan antara energi panas dan cara kerjanya.
Memahami konsep termodinamika ini sangat penting karena membantu kita memahami bagaimana energi panas dapat berubah bentuk menjadi energi lain, baik melalui proses alami maupun hasil rekayasa teknologi.
Artikel berikut akan membahas secara mendalam mengenai pengertian, hukum, sifat, dan rumus-rumus penting dalam thermodinamika.
Pengertian Termodinamika
Termodinamika adalah ilmu tentang energi, yang secara spesifik membahas mengenai hubungan antara energi panas dengan cara kerjanya. Energi tersebut dapat berubah dari satu bentuk ke bentuk lain, baik secara alami maupun melalui hasil rekayasa teknologi.
Singkatnya, termodinamika ini menjadi salah satu cabang dari bidang ilmu fisika teoritik yang berkaitan dengan hukum-hukum pergerakan panas dan perubahan dari panas menjadi bentuk energi lainnya.
Hukum-hukum Termodinamika
Keberadaan Hukum Termodinamika ini terdiri dari tiga bentuk, semuanya berasal dari pondasi yang sama, yakni Hukum Awal alias Zeroth Law. Dalam Hukum Awal Termodinamika ini dinyatakan bahwa: “Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain.”
Hukum Termodinamika I
Hukum Termodinamika I menyatakan bahwa “Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja.” Sesuai dengan bunyinya, energi yang diberikan oleh kalor pasti sama dengan kerja eksternal yang dilakukan, ditambah dengan pemerolehan energi dalam karena adanya kenaikan temperatur.
Secara tidak langsung, Hukum Termodinamika I berkaitan dengan kekekalan energi. Oleh karena itu, dalam hukum ini didapati persamaan:
$$ \Delta U = Q – W $$
Dengan \(U\) adalah perubahan energi dalam (J), \(Q\) adalah kalor yang diterima atau dilepas (J), dan \(W\) adalah usaha atau energi yang bekerja pada sistem (J). Perlu diperhatikan bahwa:
- \(Q\) bertanda positif (+) jika sistem menyerap kalor dan bertanda negatif (-) jika sistem melepas kalor.
- \(W\) bertanda positif (+) jika sistem melakukan kerja dan bertanda negatif (-) jika sistem diberikan kerja.
- \(\Delta U\) bertanda positif (+) jika sistem mengalami kenaikan suhu dan bertanda negatif (-) jika sistem mengalami penurunan suhu.
Dan pada sistem terisolasi, \(\Q = 0\) dan \(W = 0\), sehingga tidak adanya perubahan energi dalam (\(\Delta U)\).
Hukum Termodinamika II
Hukum Termodinamika II berkaitan dengan entropi dan memiliki kecenderungan bahwa “dari waktu ke waktu, perbedaan suhu, tekanan, dan potensi kimia dalam sistem fisik yang terisolasi akan menyeimbangkan diri”. Entropi adalah ukuran keseimbangan termodinamis, terutama mengenai perubahan energi.
Dalam Hukum Termodinamika II dinyatakan bahwa: “Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya.”
Hukum Termodinamika III
Hukum Termodinamika III menyatakan bahwa suatu sistem yang mencapai temperatur nol absolut (temperatur dalam kelvin), semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai minimum.
Selain itu, untuk entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Sistem dan Lingkungan
Sistem adalah tempat terjadinya reaksi termodinamika di mana terjadi pertukaran energi antara partikel zat yang terkandung. Sedangkan lingkungan adalah segala sesuatu di luar sistem.
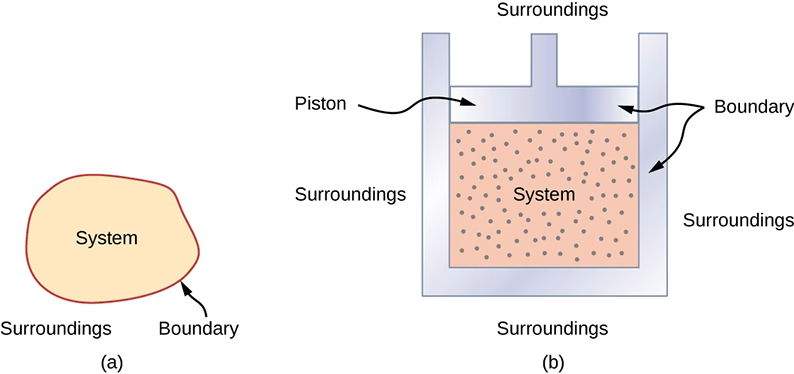
Pembatas adalah sesuatu yang mewadahi sistem dan membatasi agar sistem tidak kontak langsung dengan lingkungan. Terkadang, pembatas juga tidak diperlukan dan bisa terjadi sistem dan lingkungan berkontak langsung, seperti api unggun yang terasa hangat jika kita berada di dekatnya.
Sistem dan Lingkungan Berkaitan dengan Kalor
Kalor (\(Q\)) adalah sebuah energi yang berpindah dari satu benda ke benda yang lain akibat adanya perbedaan suhu. Jika sistem dan lingkungan berkaitan, maka kalor menjadi energi yang berpindah dari sistem ke lingkungan atau dari lingkungan ke sistem akibat adanya perbedaan suhu.
Jika suhu sistem lebih tinggi dari suhu lingkungan, maka kalor akan mengalir dari sistem menuju lingkungan. Sebaliknya, apabila suhu lingkungan lebih tinggi dari suhu sistem, maka kalor akan mengalir dari lingkungan menuju sistem.
Sebagai contoh, perhatikan gambar berikut:

Panci berisi sop merupakan sistem terbuka dan pressure cooker mendekati sistem tertutup. Sistem termodinamika adalah suatu ruang terbatas atau sejumlah materi berupa gas yang di dalamnya terjadi proses-proses termodinamika. Batas yang memisahkan sistem dari luar sistem disebut sebagai lingkungan.
- Sistem terbuka adalah sistem yang ada atau terjadi karena pertukaran massa dan energi sistem dengan lingkungannya. Contoh thermodinamika sistem terbuka biasanya sering kita temui pada fenomena alam, seperti samudra, lautan, dan tumbuh-tumbuhan.
- Sistem tertutup adalah adanya pertukaran energi namun tidak terjadi pertukaran massa sistem dengan lingkungannya. Penerapan termodinamik dalam kehidupan sehari-hari sistem tertutup adalah Green House.
- Sistem terisolir adalah tidak terjadi pertukaran, baik energi maupun massa sistem dengan lingkungan. Contoh termodinamika sistem terisolasi dalam kehidupan sehari-hari adalah tabung gas yang terisolasi.
Sistem termodinamika dapat berubah ukurannya, artinya dapat mempunyai batas yang diam atau bergerak.
Sifat-Sifat Sistem Termodinamika
Sistem termodinamika memiliki sifat-sifat termodinamika yang bersifat makroskopis, yang dapat dijelaskan secara mikroskopis. Sifat-sifat sistem dapat diukur baik langsung maupun tidak langsung pada saat sistem mengalami kesetimbangan dengan lingkungan.
Dalam keadaan seimbang, sifat harus serbamerata dalam keseluruhan sistem, misalnya hanya ada satu nilai suhu saja. Sifat sistem sebagai materi ada dua, yaitu:
- Intrinsik, tidak bergantung pada massa. Contoh: suhu, tekanan udara, dan massa jenis.
- Ekstrinsik, bergantung pada massa. Contoh: berat dan volume, energi dalam, dan entropi.
Perlu diperhatikan bahwa variabel keadaan menggambarkan keadaan sistem, bukan cara mencapai keadaan tersebut. Gas dimanfaatkan sebagai sistem dalam berbagai mesin. Contohnya, mesin uap menggunakan uap air demikian juga turbin dalam pembangkit tenaga listrik.
Kesimpulan
Termodinamika adalah ilmu tentang energi, yang secara spesifik membahas mengenai hubungan antara energi panas dengan cara kerjanya. Thermodinamika sangat bermanfaat dalam membantu penciptaan mesin dan peralatan rumah tangga.
Sistem adalah tempat terjadinya reaksi thermodinamika di mana terjadi pertukaran energi antara partikel zat yang terkandung. Sedangkan lingkungan adalah segala sesuatu di luar sistem. Sistem dan lingkungan berkaitan dengan kalor.
Referensi
- Radjawane, M. M., Tinambunan, A.T., dan Jono, S. 2022. Fisika untuk SMA/MA Kelas XI, Jakarta Pusat: Pusat Kurikulum dan Perbukuan Kementerian Pendidikan, Kebudayaan, Riset, dan Teknologi.
- Zenius.net. Materi Konsep Dasar Thermodinamika.
- Ilustrasi oleh: Radjawane, M. M., Tinambunan, A.T., dan Jono, S. 2022. Fisika untuk SMA/MA Kelas XI, Jakarta Pusat: Pusat Kurikulum dan Perbukuan Kementerian Pendidikan, Kebudayaan, Riset, dan Teknologi.



