Rangkuman
- Struktur atom merujuk pada susunan partikel-partikel penyusun atom, yang terdiri dari proton, neutron, dan elektron.
- Proton dan neutron terletak di inti atom, sementara elektron bergerak di sekitar inti dalam berbagai lintasan yang dikenal sebagai orbital.
Struktur atom adalah konsep fundamental yang menjadi dasar pemahaman kita tentang materi dan sifat-sifatnya. Atom adalah unit terkecil dari unsur yang masih mempertahankan sifat-sifat kimia unsur tersebut.
Pemahaman tentang struktur atom sangat penting dalam ilmu kimia, fisika, biologi, dan bidang lainnya.
Pengertian Struktur Atom
Struktur atom merujuk pada susunan partikel-partikel penyusun atom, yang terdiri dari proton, neutron, dan elektron.
Proton dan neutron terletak di inti atom, sementara elektron bergerak di sekitar inti dalam berbagai lintasan yang dikenal sebagai orbital.
Atom adalah unit dasar dari unsur, dan semua materi di alam semesta ini terdiri dari atom. Struktur atom tidak hanya penting untuk kimia, tetapi juga untuk fisika, biologi, dan ilmu material, karena menjadi dasar bagi banyak fenomena alam.
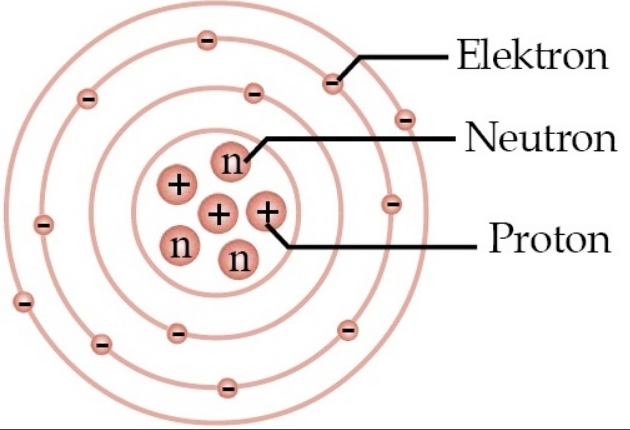
Diagram Struktur Atom
Secara umum, struktur atom dapat digambarkan sebagai berikut:
- Inti Atom: Mengandung proton dan neutron.
- Elektron: Mengorbit di sekitar inti dalam orbital tertentu.
Elektron
Elektron adalah partikel subatomik yang memiliki muatan negatif, simbolnya adalah \( e^- \). Elektron memiliki massa yang sangat kecil, sekitar \( 9.11 \times 10^{-31} \) kg, yang membuatnya tidak berpengaruh signifikan terhadap massa atom secara keseluruhan.
Elektron mengelilingi inti atom dalam berbagai tingkat energi, yang dikelompokkan ke dalam sublevel dan orbital.
Tingkat Energi Elektron
Tingkat energi elektron dapat dinyatakan dengan persamaan:
$$ E_n = – \frac{k \cdot e^2}{n^2} $$
di mana:
- \( E_n \) adalah energi tingkat ke-n,
- \( k \) adalah konstanta Coulomb,
- \( e \) adalah muatan elektron,
- \( n \) adalah nomor kuantum utama (1, 2, 3, …).
Energi elektron yang terletak pada tingkat lebih tinggi lebih besar, sehingga elektron dapat berpindah antara tingkat energi dengan menyerap atau melepaskan energi.
Proton
Proton adalah partikel subatomik yang terletak di inti atom dan memiliki muatan positif \(+1\). Jumlah proton dalam inti atom disebut sebagai nomor atom \(( Z )\), yang menentukan identitas unsur. Misalnya, hidrogen memiliki satu proton \(( Z = 1 )\), sedangkan karbon memiliki enam proton \(( Z = 6 )\).
Proton memiliki massa sekitar \( 1.67 \times 10^{-27} \) kg dan berkontribusi secara signifikan terhadap massa atom.
Gaya Elektromagnetik
Interaksi antara proton dan elektron dapat dijelaskan dengan hukum Coulomb, yang menyatakan bahwa gaya antara dua muatan dapat dihitung dengan persamaan:
$$ F = k \cdot \frac{|q_1 \cdot q_2|}{r^2} $$
di mana:
- \( F \) adalah gaya tarik-menarik atau tolak-menolak,
- \( k \) adalah konstanta Coulomb,
- \( q_1 \) dan \( q_2 \) adalah muatan,
- \( r \) adalah jarak antara muatan.
Neutron
Neutron adalah partikel subatomik yang juga terletak di inti atom, tetapi tidak memiliki muatan (netral). Massa neutron hampir sama dengan massa proton, sekitar \( 1.67 \times 10^{-27} \) kg. Neutron memiliki peran penting dalam stabilitas inti atom. Tanpa neutron, gaya tolak antara proton yang sama muatan positif dapat menyebabkan inti atom tidak stabil.
Isotop
Jumlah neutron dalam inti atom dapat bervariasi untuk unsur yang sama, menghasilkan isotop yang berbeda. Misalnya, karbon memiliki isotop \( ^{12}_6C \) (6 neutron) dan \( ^{14}_6C \) (8 neutron). Isotop memiliki sifat fisik yang berbeda meskipun memiliki jumlah proton yang sama.
Notasi Atom
Notasi atom digunakan untuk menggambarkan elemen dan isotopnya secara jelas. Notasi ini biasanya mencakup simbol unsur, nomor atom (jumlah proton), dan massa atom (jumlah proton dan neutron). Sebagai contoh, notasi untuk karbon dapat dituliskan sebagai \( ^{12}_6C \), di mana 6 adalah nomor atom (jumlah proton) dan 12 adalah massa atom (jumlah proton dan neutron).
Notasi ini sangat penting dalam ilmu kimia untuk memahami sifat-sifat unsur dan reaksi kimia. Contoh lainnya adalah notasi untuk uranium: \( ^{238}_{92}U \).
Tingkat Energi
Tingkat energi dalam atom merujuk pada energi yang dimiliki oleh elektron yang mengorbit inti. Elektron berada pada tingkat energi tertentu, dan perpindahan dari satu tingkat energi ke tingkat yang lain dapat terjadi melalui penyerapan atau pengeluaran energi.
Ketika elektron menyerap energi, mereka dapat melompat ke tingkat energi yang lebih tinggi, sedangkan ketika mereka kehilangan energi, mereka kembali ke tingkat energi yang lebih rendah.
Persamaan Tingkat Energi
Energi total sistem atom dapat dinyatakan sebagai jumlah energi kinetik dan potensial elektron. Dalam konteks model atom Bohr, energi total \( E \) dari elektron pada tingkat energi tertentu dapat dinyatakan sebagai:
$$ E = – \frac{Z^2 \cdot k^2 \cdot m \cdot e^4}{2 \hbar^2 n^2} $$
di mana:
- \( Z \) adalah nomor atom,
- \( k \) adalah konstanta Coulomb,
- \( m \) adalah massa elektron,
- \( \hbar \) adalah konstanta reduksi Planck,
- \( n \) adalah nomor kuantum utama.
Kesimpulan
Studi tentang struktur atom adalah dasar dari banyak disiplin ilmu, termasuk kimia dan fisika. Struktur atom terdiri dari proton, neutron, dan elektron, di mana masing-masing memiliki peran penting dalam menentukan sifat fisik dan kimia suatu unsur.
Proton dan neutron yang terletak di inti atom memberikan kontribusi pada massa dan stabilitas atom, sementara elektron yang mengelilingi inti memengaruhi reaktivitas dan interaksi kimia. Notasi atom dan tingkat energi juga merupakan bagian penting dari studi tentang atom.
Notasi atom memungkinkan kita untuk mengidentifikasi unsur dan isotopnya dengan jelas, sedangkan tingkat energi elektron menjelaskan bagaimana elektron berperilaku dalam interaksi dan reaksi kimia.Dengan memahami konsep-konsep ini, kita dapat lebih baik memahami fenomena alam yang kompleks dan aplikasinya dalam berbagai bidang ilmu.
Secara keseluruhan, pemahaman yang mendalam tentang struktur atom membantu kita menjelaskan banyak fenomena di alam semesta, mulai dari sifat material hingga reaksi kimia yang terjadi di sekitar kita.
Dalam ilmu pengetahuan modern, penelitian tentang struktur atom dan interaksi antarpartikel terus berkembang, membuka jalan bagi inovasi dan teknologi baru yang dapat bermanfaat bagi masyarakat. Sebagai inti dari semua materi, atom akan selalu menjadi fokus penelitian dan eksplorasi ilmiah di masa depan.
Referensi
- Fatek.umsu.ac.id. Struktur Atom: Pengertian, Jenis, dan Fungsinya
- Zenius.net. Materi Kimia Struktur Atom
- Sarah, L. L., dan Suwarna, I.R. 2022. Kimia untuk SMA/MA Kelas XII, Jakarta Pusat: Pusat Kurikulum dan Perbukuan Kementrian Pendidikan, Kebudayaan, Riset, dan Teknologi.



