Rangkuman
- Rumus kalor antara lain perpindahan kalor Q = m.c.ΔT dan rumus kalor jenis. c = Q / m.ΔT.
- Kalor adalah salah satu bentuk energi yang dapat diterima atau dilepaskan oleh benda.
Dalam dunia fisika, konsep kalor adalah salah satu yang mendasar dan penting untuk dipahami. Kalor merupakan bentuk energi yang sering kita jumpai dalam kehidupan sehari-hari, dari ketika kita memasak makanan di dapur hingga ke fenomena alam seperti perubahan musim.
Artikel ini akan membahas secara mendalam tentang pengertian kalor, rumus-rumus yang terkait, jenis-jenis kalor, metode perpindahan kalor, serta beberapa contoh soal yang diharapkan dapat membantu memperdalam pemahaman mengenai konsep ini.
Pengertian Kalor
Kalor adalah salah satu bentuk energi yang dapat diterima atau dilepaskan oleh benda. Dalam kehidupan sehari-hari, bentuk energi ini sering kita jumpai ketika memasak atau memanaskan sesuatu.
Menurut definisi, kalor merupakan energi panas yang dimiliki oleh suatu zat, yang dapat terdeteksi dengan alat pengukur suhu, seperti termometer. Kalor memiliki karakteristik unik, yaitu dapat berpindah dari satu benda ke benda lainnya, terutama dari benda yang bersuhu tinggi ke benda yang bersuhu lebih rendah ketika kedua benda bersentuhan atau dekat.
Perlu diketahui bahwa kalor dan suhu adalah dua hal yang berbeda. Suhu adalah ukuran derajat panas suatu benda dan umum diukur dengan termometer, sementara kalor adalah energi yang menyebabkan perubahan suhu tersebut.
Menurut Sistem Internasional (SI), satuan kalor adalah joule (J). Namun, dalam beberapa konteks, satuan kalori (cal) masih sering digunakan, terutama dalam bidang gizi. Satu kalori didefinisikan sebagai jumlah energi yang diperlukan untuk menaikkan suhu 1 gram air sebesar 1 derajat Celsius, yang setara dengan 4,184 joule.
Rumus-Rumus Terkait Kalor
Pemahaman mengenai kalor akan semakin baik jika kita mengenal rumus-rumus yang berkaitan dengan perpindahan dan pengukuran kalor. Berikut ini adalah beberapa rumus penting dalam konteks kalor:
1. Rumus Perpindahan Kalor
Perpindahan kalor antara dua benda dapat dirumuskan sebagai berikut:
$$ Q = m \cdot c \cdot \Delta T $$
Di sini, \(Q\) adalah banyaknya kalor yang diterima atau dilepas (J), \(m\) adalah massa benda (kg), \(c\) adalah kalor jenis benda (J/kg°C), dan\(\Delta T\) adalah perubahan suhu (°C).
Contoh:
Jika sebuah benda bermassa 2 kg dipanaskan sehingga suhunya berubah dari 25°C menjadi 75°C, dan kalor jenis benda tersebut adalah 900 J/kg°C, maka kalor yang diserap oleh benda tersebut dapat dihitung sebagai berikut:
$$ Q = 2 \, \text{kg} \cdot 900 \, \text{J/kg}^\circ \text{C} \cdot 50^\circ \text{C} = 90.000 \, \text{J}$$
2. Rumus Kalor Jenis
Kalor jenis suatu zat dapat dirumuskan sebagai berikut:
$$ c = \frac{Q}{m \cdot \Delta T} $$
Contoh:
Sebuah zat cair dengan massa 5 kg memerlukan 250.000 J untuk meningkatkan suhunya dari 30°C menjadi 80°C. Kalor jenis zat cair tersebut adalah:
$$ c = \frac{250.000 \, \text{J}}{5 \, \text{kg} \cdot 50^\circ \text{C}} = 1000 \, \text{J/kg}^\circ \text{C} $$
3. Rumus Kapasitas Kalor
Kapasitas kalor sebuah benda dapat dirumuskan sebagai berikut:
$$ C = \frac{Q}{\Delta T} $$
Contoh:
Jika sebuah benda bersuhu 5°C menyerap kalor sebesar 1500 joule dan suhunya naik menjadi 32°C, kapasitas kalor benda tersebut adalah:
$$ C = \frac{1500 \, \text{J}}{32^\circ \text{C} – 5^\circ \text{C}} = \frac{1500 \, \text{J}}{27^\circ \text{C}} = 55.56 \, \text{J/K} $$
4. Rumus Menentukan Kapasitas Kalor Itu Sendiri
Kapasitas kalor juga bisa dihitung dengan rumus berikut:
$$ C = m \cdot c $$
5. Rumus Kalor Lebur dan Uap
Untuk menghitung kalor lebur dan uap, digunakan rumus:
$$ Q = m \cdot L $$
untuk kalor lebur, dan
$$ Q = m \cdot U $$
untuk kalor uap, di mana \(L\) adalah kalor lebur zat (Joule/kilogram) dan \(U\) adalah kalor uap zat (Joule/kilogram).
Contoh:
Jika sebuah es dengan massa 3 kg dilebur pada suhu 0°C dan kalor lebur es adalah 334 kJ/kg, energi yang diperlukan adalah:
$$Q = 3 \, \text{kg} \cdot 334 \, \text{kJ/kg} = 1002 \, \text{kJ}$$
Jenis-Jenis Kalor
Kalor yang kita pelajari bisa dibedakan menjadi beberapa jenis berdasarkan proses bekerjanya pada zat tertentu. Berikut ini jenis-jenis kalor:
- Kalor Pembentukan (∆Hf)
Kalor pembentukan adalah kalor yang dihasilkan atau dibutuhkan untuk membuat 1 mol senyawa dalam unsur-unsurnya. Contoh: C12, O2, Br2, H2. - Kalor Penguraian (∆Hd)
Kalor penguraian adalah bentuk kalor yang dihasilkan atau dibutuhkan untuk mengurai 1 mol senyawa menjadi unsur-unsurnya. - Kalor Pembakaran (∆Hc)
Kalor pembakaran adalah kalor yang didapat atau diperlukan untuk membakar 1 mol zat, baik unsur maupun senyawanya. - Kalor Netralisasi (∆Hn)
Kalor netralisasi adalah kalor yang didapatkan atau dibutuhkan untuk membentuk 1 mol H2O dari reaksi antara asam dan basa. Ini termasuk dalam reaksi eksoterm karena adanya peningkatan suhu. - Kalor Pelarutan (∆Hs)
Kalor pelarutan adalah kalor yang dibutuhkan untuk melarutkan 1 mol zat dari keadaan padat menjadi larutan.
Kalor Jenis dan Kapasitas Kalor
Kalor jenis adalah jumlah energi kalor yang dibutuhkan untuk meningkatkan suhu 1 kg zat sebesar 1°C. Setiap benda memiliki kalor jenis yang berbeda-beda. Misalnya, kalor jenis air adalah 4200 J/kg°C, alkohol adalah 550 J/kg°C, dan es adalah 2090 J/kg°C.
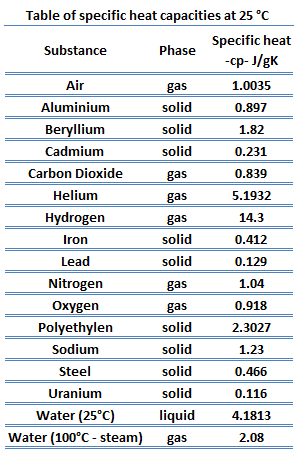
Kapasitas kalor adalah jumlah energi kalor yang dibutuhkan untuk meningkatkan suhu suatu benda tertentu sebesar 1°C. Kapasitas kalor ini bergantung pada massa benda dan kalor jenisnya.
Perubahan Kalor
Kalor yang diterima atau dilepaskan oleh suatu benda dapat menyebabkan dua jenis perubahan: perubahan suhu dan perubahan wujud.
Kalor Mengubah Suhu Zat
Ketika suatu zat menerima kalor, suhunya akan meningkat. Sebaliknya, ketika suatu zat melepaskan kalor, suhunya akan menurun. Misalnya, air yang dipanaskan akan mengalami peningkatan suhu.
Contoh lain adalah ketika kita memanaskan 4 kg air dari 25°C menjadi 100°C dengan kalor jenis air 4200 J/kg°C:
$$ Q = m \cdot c \cdot \Delta T = 4 \, \text{kg} \cdot 4200 \, \text{J/kg}^\circ \text{C} \cdot 75^\circ \text{C} = 1.260.000 \, \text{J}$$
Kalor Mengubah Wujud Zat
Ketika suatu zat dipanaskan atau didinginkan, zat tersebut dapat berubah wujud. Misalnya, es yang dipanaskan akan berubah menjadi air, dan air yang dipanaskan lebih lanjut akan berubah menjadi uap. Ini dapat dijelaskan lebih lanjut menggunakan konsep kalor lebur dan kalor uap.
Macam-Macam Perpindahan Kalor
Ada tiga metode utama perpindahan kalor: konduksi, konveksi, dan radiasi.
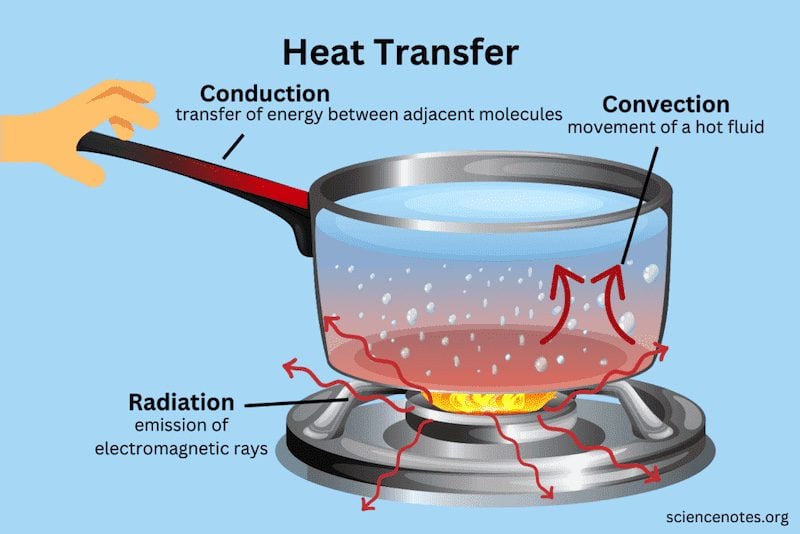
Konduksi
Konduksi adalah perpindahan kalor melalui zat perantara tanpa adanya perpindahan partikel-partikel zat secara permanen. Medium yang menghantarkan kalor dengan baik disebut konduktor (misalnya logam), sedangkan yang menghantarkan kalor buruk disebut isolator (misalnya kayu).
Contoh konduksi adalah ketika kita memanaskan ujung logam, ujung lainnya juga akan memanas. Rumus yang digunakan:
$$\text{Laju Kalor} = \frac{Q}{t} = \frac{kA (T_2 – T_1)}{x}$$
di mana k adalah konduktivitas termal, A adalah luas penampang, T2 adalah suhu panas, T1 adalah suhu dingin, dan x adalah panjang medium konduktor.
Konveksi
Konveksi adalah perpindahan kalor yang disertai dengan perpindahan bagian-bagian zat itu sendiri. Ada dua jenis konveksi: konveksi alami dan konveksi paksa.
Konveksi alami terjadi karena perbedaan massa jenis, sementara konveksi paksa melibatkan pengaruh dari faktor luar seperti tekanan. Contoh konveksi alami adalah pemanasan air, di mana air yang panas mengalir ke atas dan air yang dingin turun ke bawah. Contoh konveksi paksa adalah radiator mobil yang menggunakan kipas untuk mendinginkan mesin.
Rumus yang digunakan:
$$ \text{Laju Kalor} = \frac{Q}{t} = hA (T_2 – T_1)$$
di mana h adalah koefisien perpindahan kalor, A adalah luas permukaan, T2 adalah suhu permukaan, dan T1 adalah suhu lingkungan.
Radiasi
Radiasi adalah perpindahan kalor tanpa memerlukan zat perantara. Energi panas dipancarkan dalam bentuk gelombang elektromagnetik, seperti sinar matahari yang mencapai Bumi tanpa perantara.
Contoh lain adalah ketika kita merasa hangat di dekat api unggun tanpa bersentuhan dengan api tersebut. Rumus yang digunakan:
$$ \text{Laju Kalor} = \frac{Q}{t} = \sigma e AT^4 $$
di mana σ adalah konstanta Stefan-Boltzmann, e adalah emisivitas, A adalah luas permukaan, dan T adalah suhu dalam Kelvin.
Contoh Soal Tentang Kalor
Soal Pilihan Ganda
Soal 1
Jika sebuah benda bermassa 2 kg dipanaskan sehingga suhunya berubah dari 25°C menjadi 75°C, dan kalor jenis benda tersebut adalah 900 J/kg°C, berapakah kalor yang diserap oleh benda tersebut?
A. 90.000 J
B. 36.000 J
C. 45.000 J
D. 27.000 J
Pembahasan:
$$Q = m \cdot c \cdot \Delta T = 2 \, \text{kg} \cdot 900 \, \text{J/kg}^\circ \text{C} \cdot 50^\circ \text{C} = 90.000 \, \text{J}$$
Jawaban: A. 90.000 J
Soal 2
Sebuah zat cair dengan massa 5 kg memerlukan 250.000 J untuk meningkatkan suhunya dari 30°C menjadi 80°C. Berapakah kalor jenis zat cair tersebut?
A. 500 J/kg°C
B. 1000 J/kg°C
C. 800 J/kg°C
D. 1200 J/kg°C
Pembahasan:
$$ c = \frac{250.000 \, \text{J}}{5 \, \text{kg} \cdot 50^\circ \text{C}} = 1000 \, \text{J/kg}^\circ \text{C}$$
Jawaban: B. 1000 J/kg°C
Soal 3
Berapa energi yang diperlukan untuk melebur 3 kg es pada suhu 0°C, jika kalor lebur es adalah 334 kJ/kg?
A. 1002 kJ
B. 334 kJ
C. 1500 kJ
D. 668 kJ
Pembahasan:
$$ Q = m \cdot L = 3 \, \text{kg} \cdot 334 \, \text{kJ/kg} = 1002 \, \text{kJ} $$
Jawaban: A. 1002 kJ
Soal Esai
Soal 1
Berapa energi yang dibutuhkan untuk memanaskan 4 kg air dari suhu 25°C menjadi 100°C? Kalor jenis air adalah 4200 J/kg°C.
Pembahasan:
$$ Q = m \cdot c \cdot \Delta T = 4 \, \text{kg} \cdot 4200 \, \text{J/kg}^\circ \text{C} \cdot 75^\circ \text{C} = 1.260.000 \, \text{J} $$
Soal 2
Sebuah logam dengan massa 3 kg menyerap 540.000 J energi panas. Jika perubahan suhu logam tersebut adalah 100°C, berapakah kalor jenis logam tersebut?
Pembahasan:
$$c = \frac{540.000 \, \text{J}}{3 \, \text{kg} \cdot 100^\circ \text{C}} = 1800 \, \text{J/kg}^\circ \text{C}$$
Soal 3
Berapa banyak kalor yang dibutuhkan untuk mengubah 5 kg air pada 100°C menjadi uap air pada 100°C? Kalor uap air adalah 2260 kJ/kg.
Pembahasan:
$$Q = m \cdot U = 5 \, \text{kg} \cdot 2260 \, \text{kJ/kg} = 11.300 \, \text{kJ}$$
Kesimpulan
Kalor adalah salah satu bentuk energi yang penting dalam fisika dan kehidupan sehari-hari. Memahami konsep kalor, termasuk rumus-rumus yang terkait, jenis-jenis kalor, dan metode perpindahannya, sangat vital untuk banyak aplikasi praktis, mulai dari kehidupan sehari-hari hingga industri.
Dengan menguasai konsep dasar ini, kita dapat lebih memahami dan mengapresiasi fenomena-fenomena yang terjadi di sekitar kita.
Referensi
- Gramedia.com. Pengertian Kalor: Rumus, Kapasitas, Jenis, Perpindahan, Dan Contoh Soalnya
- Sampoernaacademy.sch.id. Pengertian Kalor: Rumus, Jenis Perpindahan, dan Contoh Soal
- Ruangguru.com. Memahami Kalor dan Rumus-Rumusnya | Fisika Kelas 11
- nuclear-power.com. Heat Capacity – Specific Heat Capacity
- Ilustrasi oleh Unsplash.com



