Rangkuman
- Penemuan inti atom dimulai dari eksperimen Ernest Rutherford yang mengamati hamburan partikel alfa pada foil emas.
- Atom terdiri dari tiga partikel utama: proton, neutron, dan elektron, dengan inti atom sebagai pusatnya yang terdiri dari proton dan neutro
Penemuan inti atom menandai salah satu langkah paling revolusioner dalam ilmu pengetahuan modern.
Melalui penemuan ini, kita memperoleh pemahaman mendalam tentang struktur terkecil materi dan bagaimana atom membentuk dunia di sekitar kita.
Sejarah Singkat Penemuan Inti dan Atom
Konsep atom berasal dari masa Yunani kuno, sekitar abad ke-5 SM, ketika para filsuf seperti Demokritos dan Leucippos memperkenalkan ide bahwa semua benda terdiri dari partikel-partikel yang sangat kecil dan tak terpisahkan, yang mereka sebut “atomos.”
Namun, konsep ini lebih bersifat spekulatif dan filosofis daripada ilmiah, karena pada masa itu belum ada cara untuk membuktikan keberadaan atom secara empiris.
Barulah pada abad ke-19, gagasan atom mulai mendapatkan dasar ilmiah yang lebih kuat. John Dalton, seorang ilmuwan Inggris, mengembangkan teori atom modern pertama pada awal tahun 1800-an.
Menurut Dalton, unsur-unsur terdiri dari partikel-partikel yang sangat kecil dan tidak dapat dibagi lagi yang disebut atom. Ia juga mengemukakan bahwa atom dari unsur yang sama memiliki massa yang sama, sedangkan atom dari unsur yang berbeda memiliki massa yang berbeda.
Namun, pemahaman tentang atom masih sangat terbatas hingga akhir abad ke-19, ketika penemuan sinar katoda dan elektron oleh J.J. Thomson pada tahun 1897 mengubah pandangan dunia tentang struktur atom.
Thomson menunjukkan bahwa atom bukanlah partikel yang solid dan tak terbagi, melainkan memiliki struktur internal yang terdiri dari partikel bermuatan negatif yang lebih kecil, yang kemudian dikenal sebagai elektron.
Berdasarkan penemuannya, Thomson mengusulkan model “plum pudding” untuk struktur atom, di mana elektron tersebar di dalam atom seperti kismis dalam puding. Meskipun model Thomson menandai kemajuan besar dalam pemahaman tentang atom, model ini segera terbantahkan oleh eksperimen yang lebih lanjut.
Pada awal abad ke-20, fisikawan Ernest Rutherford melakukan serangkaian eksperimen yang mengarah pada penemuan inti atom, yang menggantikan model plum pudding dengan model atom yang lebih akurat dan revolusioner.
Tokoh Penemuan Inti Atom
Ernest Rutherford – Bapak Penemuan Inti Atom
Ernest Rutherford adalah tokoh kunci dalam penemuan inti atom. Pada tahun 1909, Rutherford bersama rekan-rekannya, Hans Geiger dan Ernest Marsden, melakukan eksperimen yang dikenal sebagai eksperimen hamburan partikel alfa atau “eksperimen foil emas.”
Dalam eksperimen ini, mereka menembakkan partikel alfa (nukleus helium) ke selembar tipis emas.Jika model atom “plum pudding” benar, mereka mengharapkan partikel alfa akan melewati foil emas tanpa banyak perubahan arah. Namun, hasil eksperimen ini menunjukkan sesuatu yang sangat berbeda: sebagian besar partikel alfa melewati foil, tetapi beberapa partikel dibelokkan pada sudut yang sangat besar, dan bahkan ada yang memantul kembali.
Rutherford menyimpulkan bahwa atom sebagian besar terdiri dari ruang kosong, tetapi memiliki pusat kecil dan padat yang bermuatan positif, yang ia sebut “inti atom.” Partikel alfa yang dibelokkan dengan tajam merupakan hasil dari interaksi antara inti atom dan partikel alfa yang bermuatan positif.
Berdasarkan eksperimen ini, Rutherford mengusulkan model atom yang baru, di mana elektron mengorbit inti atom yang padat dan bermuatan positif, mirip dengan planet yang mengorbit matahari.
Penemuan Rutherford tentang inti atom mengubah cara ilmuwan memandang struktur atom dan menandai langkah besar dalam pemahaman tentang materi di tingkat fundamental. Inti atom sekarang dipahami sebagai pusat dari atom yang mengandung sebagian besar massa atom, sedangkan elektron berputar di sekitar inti dalam orbit-orbit tertentu.
Niels Bohr – Penyempurnaan Model Atom
Setelah penemuan inti atom oleh Rutherford, fisikawan Denmark Niels Bohr memperkenalkan perbaikan lebih lanjut pada model atom. Pada tahun 1913, Bohr mengembangkan model atom yang menggabungkan gagasan inti atom Rutherford dengan teori kuantum.
Bohr mengusulkan bahwa elektron mengorbit inti pada jarak-jarak tertentu, dan elektron hanya dapat menempati orbit-orbit ini. Ketika elektron berpindah dari satu orbit ke orbit lain, mereka menyerap atau memancarkan energi dalam jumlah yang diskret, yang disebut kuanta.
Model Bohr membantu menjelaskan spektrum cahaya yang dipancarkan oleh atom, khususnya atom hidrogen, dan memberikan landasan bagi perkembangan mekanika kuantum di kemudian hari. Meskipun model Bohr pada akhirnya digantikan oleh model mekanika kuantum yang lebih canggih, kontribusinya sangat penting dalam memahami struktur atom.
James Chadwick – Penemuan Neutron
Pada tahun 1932, James Chadwick, seorang fisikawan Inggris, menemukan neutron, partikel netral yang membentuk inti atom bersama proton. Sebelum penemuan neutron, ilmuwan memahami bahwa inti atom terdiri dari proton yang bermuatan positif, tetapi jumlah proton saja tidak cukup untuk menjelaskan semua sifat inti atom, terutama massa inti yang lebih besar dari jumlah proton.
Chadwick menunjukkan bahwa inti atom juga mengandung neutron, partikel tanpa muatan tetapi memiliki massa yang hampir sama dengan proton.
Penemuan neutron melengkapi gambaran tentang inti atom dan memungkinkan ilmuwan memahami fenomena-fenomena seperti isotop, yaitu atom-atom dari unsur yang sama yang memiliki jumlah neutron yang berbeda di dalam intinya.
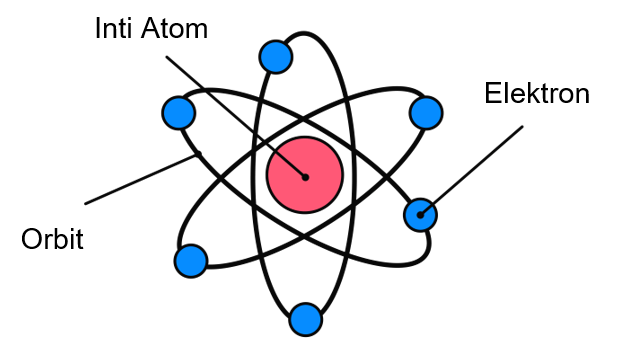
Karakteristik Atom dan Inti Atom
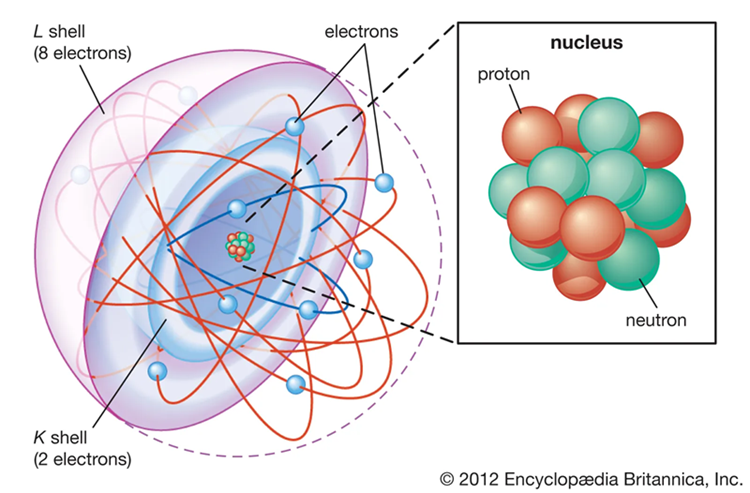
Atom merupakan unit dasar dari materi yang terdiri dari tiga partikel utama: proton, neutron, dan elektron.
Inti atom adalah pusat atom yang sangat padat dan terdiri dari proton dan neutron, yang bersama-sama disebut nukleon. Karakteristik atom dan inti atom dapat dijelaskan melalui beberapa aspek penting:
1. Proton:
Proton adalah partikel bermuatan positif yang berada di dalam inti atom. Jumlah proton dalam inti atom menentukan identitas unsur tersebut, yang disebut nomor atom.
Misalnya, atom hidrogen memiliki satu proton, sedangkan atom karbon memiliki enam proton. Muatan positif proton sebanding dengan muatan negatif elektron, sehingga atom netral secara listrik.
2. Neutron:
Neutron adalah partikel netral yang juga terdapat dalam inti atom. Jumlah neutron dalam inti atom dapat bervariasi, menghasilkan isotop yang berbeda dari unsur yang sama. Sebagai contoh, karbon-12 memiliki enam neutron, sedangkan karbon-14 memiliki delapan neutron.
Neutron membantu menstabilkan inti atom dengan mengurangi tolakan elektromagnetik antar proton yang bermuatan positif.
3. Elektron:
Elektron adalah partikel bermuatan negatif yang mengorbit inti atom pada jarak tertentu. Jumlah elektron dalam atom netral sama dengan jumlah proton dalam inti, sehingga muatan positif dan negatif saling menetralkan.
Elektron berada dalam tingkat energi atau kulit atom, dan distribusi elektron dalam kulit-kulit ini menentukan sifat kimia atom.
4. Isotop:
Isotop adalah atom dari unsur yang sama dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Beberapa isotop bersifat stabil, sementara yang lain bersifat radioaktif dan dapat meluruh menjadi unsur lain.
Contoh isotop yang terkenal adalah karbon-14, yang digunakan dalam penanggalan radiokarbon untuk menentukan usia benda-benda purbakala.
5. Energi Ikat Inti:
Energi ikat inti adalah energi yang diperlukan untuk memisahkan proton dan neutron dari inti atom. Ini adalah salah satu alasan mengapa inti atom sangat stabil.
Energi ikat inti juga berperan dalam reaksi nuklir seperti fisi dan fusi, yang melibatkan pelepasan energi dalam jumlah besar.
Kesimpulan
Penemuan inti atom merupakan salah satu pencapaian ilmiah paling penting dalam sejarah, yang mengubah pemahaman manusia tentang struktur dasar materi.
Melalui eksperimen yang dipelopori oleh Ernest Rutherford, para ilmuwan berhasil menemukan bahwa atom bukanlah partikel solid, melainkan memiliki pusat kecil yang padat dan bermuatan positif, yaitu inti atom.
Tokoh-tokoh seperti Niels Bohr dan James Chadwick kemudian memperdalam pemahaman ini dengan mengembangkan teori orbit elektron dan menemukan neutron, yang melengkapi gambaran struktur inti atom.
Atom terdiri dari tiga partikel utama: proton, neutron, dan elektron, dengan inti atom sebagai pusatnya yang terdiri dari proton dan neutron. Proton menentukan identitas unsur, sementara neutron berperan dalam menstabilkan inti dan membentuk isotop.
Referensi
- Kumparan.com. Sejarah Penemuan Inti Atom Singkat dan Tokoh-tokoh yang Mengembangkannya
- fatek.umsu.ac.id. Apa Itu Atom? Sejarah dan Strukturnya
- Sarah, L. L., dan Suwarna, I.R. 2022. Fisika untuk SMA/MA Kelas XII, Jakarta Pusat: Pusat Kurikulum dan Perbukuan Kementrian Pendidikan, Kebudayaan, Riset, dan Teknologi.



