Rangkuman
- Gas ideal adalah model teoretis dari gas yang digunakan dalam fisika dan kimia untuk memudahkan pemahaman dan perhitungan mengenai perilaku gas.
- Gas ideal memenuhi hukum gas ideal yaitu (pV = nRT), di mana (p), (V), dan (T) masing-masing menyatakan tekanan, volume, dan suhu.
Gas adalah salah satu bentuk zat yang unik, memiliki volume dan bentuk yang dapat berubah-ubah sesuai dengan wadah yang ditempatinya.
Salah satu sifat karakteristik dari gas adalah kemampuannya untuk memuai dengan cepat saat dipanaskan karena koefisien muainya yang lebih besar dibandingkan zat cair dan zat padat.
Pemahaman tentang perilaku gas ini menjadi dasar bagi teori kinetik gas, yang menjelaskan perilaku molekul gas dalam berbagai kondisi.
Pengertian Gas dan Gas Ideal
Gas merupakan salah satu bentuk dan wujud zat yang memiliki volume serta bentuk yang dapat berubah-ubah sesuai dengan wadahnya, dan sulit dilihat oleh mata manusia.
Gas memiliki koefisien muai lebih besar dibanding zat cair dan zat padat. Sehingga, gas menempati suatu ruang dengan cepat dan memuai dengan cepat juga. Kondisi pada gas menempati ruang dan pemuaian dengan cepat menjadi dasar pemahaman teori kinetik gas.
Gas ideal adalah model teoretis dari gas yang digunakan dalam fisika dan kimia untuk memudahkan pemahaman dan perhitungan mengenai perilaku gas. Dalam model ini, gas dianggap terdiri dari partikel-partikel individu yang sangat kecil dan bergerak acak dengan kecepatan tinggi. Beberapa asumsi dasar yang digunakan dalam model gas ideal meliputi:
- Gerak Acak: Partikel-partikel gas bergerak secara acak dan terus-menerus ke segala arah.
- Tidak Ada Gaya Tarik-Menarik: Tidak ada gaya tarik-menarik atau tolak-menolak yang signifikan antara partikel-partikel gas kecuali saat mereka bertumbukan.
- Tumbukan Elastis Sempurna: Tumbukan antara partikel gas ataupun dengan dinding wadah bersifat elastis sempurna, yang berarti tidak ada kehilangan energi dalam bentuk panas selama tumbukan.
- Volume Partikel Diabaikan: Volume partikel-partikel gas dianggap sangat kecil dibandingkan dengan volume total gas, sehingga volume partikel-partikel gas dapat diabaikan.
Hukum – Hukum Tentang Gas
Hukum Boyle
Hukum Boyle, yang dirumuskan oleh ilmuwan asal Inggris, Robert Boyle, berbunyi “jika suhu gas tetap konstan, tekanan gas akan berbanding terbalik dengan volumenya.”
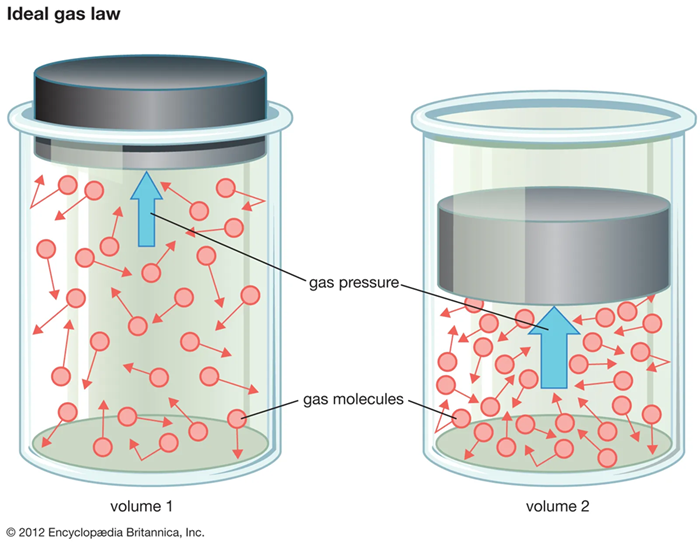
Hukum Boyle berlaku pada keadaan gas yang mengalami proses pada suhu dan jumlah mol yang tidak berubah atau konstan. Dalam istilah lain, ini dapat diungkapkan sebagai hasil perkalian antara tekanan dan volume gas pada suhu tertentu, yang tetap atau isotermal. Diperoleh persamaan sebagai berikut:
$$ pV = \text{Konstan} $$
Jika terdapat perbedaan keadaan gas, maka berlaku persamaan di bawah ini:
$$ p_1V_1 = p_2V_2 $$
Dengan \(p_1\) adalah tekanan gas mula-mula (atm, cmHg, N/m², Pa), \(V_1\) adalah Volume gas mula-mula (m³, cm³), \(p_2\) adalah tekanan gas akhir (atm, cmHg, N/m², Pa), dan \(V_2\) adalah Volume gas akhir (m³, cm³).
Hukum Charles
Jika Hukum Boyle membahas tentang pengaruh tekanan dan volume pada suhu tetap, Hukum Charles, yang ditemukan oleh Jacques Charles, berbeda. Hukum ini menyatakan bahwa “jika tekanan suatu gas dijaga tetap, maka volume gas akan berbanding lurus dengan suhu mutlaknya.”
Dalam istilah lain, Hukum Charles dapat diungkapkan sebagai hasil bagi antara volume dan suhu pada tekanan yang konstan, juga dikenal sebagai isobar. Dengan rumusnya adalah:
$$ \frac{V}{T} = \text{Konstan} $$
$$ \frac{V_1}{T_1} = \frac{V_2}{T_2} $$
Dengan \(V\) adalah volume gas pada tekanan tetap (m³), \(T\) adalah suhu gas pada tekanan tetap (K), \(V_\) adalah volume gas pada keadaan I (m³), \(V_2\) adalah volume gas pada keadaan II (m³), \(T_1\) adalah suhu gas pada keadaan I (K) dan \(T_2\) adalah suhu gas pada keadaan II (K).
Hukum Gay-Lussac
Joseph Louis Gay-Lussac (1778 – 1850), seorang ahli fisika Prancis, mempelajari hubungan antara tekanan (p) dan suhu (T) dari gas pada keadaan tertentu.
Hukum Gay-Lussac menyebutkan bahwa “tekanan dari massa gas berbanding lurus dengan suhu mutlak gas, saat volume dipertahankan dalam keadaan konstan”. Dengan kata lain, proses ini terjadi dalam kondisi isokhorik, dimana volume gas tetap. Berikut adalah rumus Hukum Gay-Lussac dalam bentuk matematis:
$$ \frac{p}{T} = \text{Konstan} $$
$$ \frac{p_1}{T_1} = \frac{p_2}{T_2} $$
Dengan \(p\) adalah tekanan gas pada volume tetap (Pa), \(T\) adalah suhu gas pada volume tetap (K), \(p_1\) adalah tekanan gas pada keadaan I (Pa), \(p_2\) adalah tekanan gas pada keadaan II (Pa), \(T_1\) adalah suhu gas pada keadaan I (K) dan \(T_2\) adalah suhu gas pada keadaan II (K).
Hukum Avogadro
Amedeo Carlo Avogadro (1776-1856), seorang ilmuwan Italia, melakukan eksperimen yang mengaitkan volume gas (V) dengan jumlah mol (n) zat gas tersebut pada keadaan tertentu.
Hukum Avogadro menyatakan bahwa “pada suhu dan tekanan yang sama maka gas dengan volume yang sama mempunyai jumlah molekul yang sama”. Secara matematis hukum Avogadro diberikan oleh persamaan:
$$ \frac{V}{n} = \text{Konstan} $$
$$ \frac{V_1}{n_1} = \frac{V_2}{n_2} $$
Dengan \(V\) adalah volume gas pada suhu dan tekanan tetap (m³), \(n\) adalah jumlah mol gas pada suhu dan tekanan tetap (mol), \(V_1\) adalah volume gas pada keadaan I (m³), \(V_2\) adalah volume gas pada keadaan II (m³), \(n_1\) adalah jumlah mol gas pada keadaan I (mol) dan \(n_2\) adalah jumlah mol gas pada keadaan II (mol).
Gas Nyata dan Hukum Gas Ideal
Gas yang biasa kita jumpai dalam kehidupan sehari-hari merupakan gas nyata. Sedangkan, gas ideal adalah gas yang bersifat teoritis dan tidak nyata. Gas yang berada di tekanan rendah dan suhunya tidak mendekati titik cair gas dianggap mendekati karakter gas ideal, sehingga gas tersebut diasumsikan sebagai gas ideal dalam kehidupan nyata.
Gas ideal adalah kumpulan partikel pada suatu zat yang jaraknya berjauhan dibanding ukuran partikel tersebut.
Partikel dalam gas selalu bergerak secara acak ke segala arah dan dapat bertumbukan satu sama lain, tetapi pada gas ideal, tumbukan yang terjadi merupakan tumbukan lenting sempurna yang tidak membuat partikel kehilangan energinya.
Contoh gas yang mendekati karakter gas ideal adalah nitrogen, oksigen, hidrogen, gas mulia, dan karbon dioksida.
Model gas ideal dikembangkan karena sangat berguna dalam mempelajari kelakuan gas sehingga memudahkan para insinyur untuk mengembangkan dan meramalkan sifat-sifat gas sebagai suatu sistem dalam kondisi tertentu.
Perhatikan hubungan \(p\), \(V\), \(T\), dan \(n\) pada setiap waktu untuk gas nyata menurut persamaan berikut:
$$ \left[ p + \frac{an^2}{V^2} \right] \left( V – nb \right) = nRT $$
Dimana \(a\) dan \(b\) berbeda untuk gas yang berbeda. Faktor \(a\) menunjukkan pengaruh rata-rata gaya tarik-menarik di antara molekul gas dan faktor \(b\) menunjukkan pengaruh volume molekul gas pada keadaan gas.
Hukum gas ideal atau persamaan gas ideal diperoleh dengan menggabungkan hukum-hukum gas yang telah dibahas sebelumnya (Hukum Boyle, Hukum Charles, Hukum Gay-Lussac, dan Hukum Avogadro). Persamaan gas ideal diberikan oleh:
$$ pV = nRT $$
Dengan \(p\) adalah tekanan mutlak pada gas (Pa), \(V\) adalah volume (m³), \(n\) adalah jumlah molekul pada gas (mol), \(T\) adalah suhu (K), dan \(R\) adalah konstanta gas ideal dengan nilai 8,314472 J⋅K⁻¹⋅mol⁻¹.
Gas nyata berlaku seperti gas ideal pada tekanan rendah dan suhu tinggi. Dengan mensubstitusi kedua persamaan, diperoleh persamaan dalam bentuk yang lain:
$$ pV = NkT $$
Dengan \(N\) adalah jumlah partikel, \(N_A\) adalah bilangan Avogadro (6,02 x 10²³/mol), dan \(k\) adalah konstanta Boltzmann (1,38 x 10⁻²³ J/K) = \(R/N_A\).
Kesimpulan
Gas yang biasa kita jumpai dalam kehidupan sehari-hari disebut sebagai gas nyata. Gas nyata memenuhi beberapa hukum gas yang mengatur hubungan antara tekanan, volume, dan suhu, meskipun perilakunya tidak selalu ideal dan kadang-kadang menyimpang dari model teoretis yang disederhanakan.
Gas ideal adalah konsep teoretis yang digunakan untuk mempermudah pemahaman perilaku gas. Berbeda dengan gas nyata, gas ideal memenuhi hukum gas ideal yaitu (pV = nRT), di mana (p), (V), dan (T) masing-masing menyatakan tekanan, volume, dan suhu. Model gas ideal membantu meramalkan sifat-sifat gas dengan lebih mudah, meskipun tidak sepenuhnya menggambarkan kondisi nyata.
Referensi
- Radjawane, M. M., Tinambunan, A.T., dan Jono, S. 2022. Fisika untuk SMA/MA Kelas XI, Jakarta Pusat: Pusat Kurikulum dan Perbukuan Kementrian Pendidikan, Kebudayaan, Riset, dan Teknologi.
- Quipper.com. Materi Gas Ideal: Pengertian, Ciri-ciri, Syarat, Lengkap dengan Rumusnya.
- Pijarbelajar.id. Gas Ideal: Pengertian, Syarat, Hukum, Rumus, Energi Kinetik dan Contoh Soalnya.



